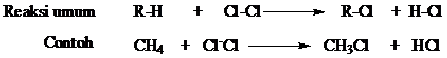1. oksidasi dengan kalium manganat
Alkena bereaksi dengan larutan kalium manganat(VII) dalam suasana dingin. Perubahan warna tergantung pada apakah kalium manganat(VII) digunakan dalam kondisi asam atau basa.
Jika larutan kalium manganat(VII) diasamkan dengan asam sulfat encer, maka larutan akan berubah warna dari ungu menjadi tidak berwarna.
Jika larutan kalium manganat(VII) dijadikan sedikit bersifat basa (biasanya dengan menambahkan larutan natrium karbonat), larutan ungu pertama-tama berubah menjadi hijau tua dan selanjutnya menghasilkan endapan berwarna coklat gelap.
Apabila alkena dioksidasi, maka kemungkinan produk yang
dihasilkan adalah alkohol, aldehid, keton, atau asam karboksilat. Semua
tergantung suhu dan suasana serta struktur alkena sendiri. Terdapat dua suasana
yang memberikan produk yang berbeda. Dalam suasana basa, apabila alkena
dioksidasi, akan membentuk diol. Sedangkan dalam suasana asam, akan
menghasilkan 2 zat yang terpisah karena terjadi pemutusan ikatan. Biasanya
berupa aldehid. Sedangkan untuk KMnO4 (Berwarna Ungu) sendiri, dalam suasana
basa akan membentuk endapan Mangan(IV) oksida (MnO2) berwarna coklat. Sedangkan
dalam suasana asam akan membentuk larutan Mn2+ yang tidak berwarna.
Sifat kimia reaksi
Kita akan melihat reaksi dengan etena. Alkena-alkena yang lain bereaksi persis sama dengan etena.
Ion-ion manganat(VII) merupakan agen pengoksidasi kuat, dan etena dioksidasi menjadi etana-1,2-diol (nama lama: etilen glikol).
Jika persamaan reaksinya ditinjau murni dari sudut pandang reaksi organik, maka dapat dituliskan:
Persamaan reaksi lengkapnya tergantung pada kondisi-kondisi reaksi.
Dibawah kondisi asam, ion-ion manganat(VII) direduksi menjadi ion-ion mangan(II).
Dibawah kondisi basa, ion-ion manganat(VII) pertama-tama direduksi menjadi ion-ion manganat(VI) yang berwarna hijau sesuai persamaan berikut:
dan selanjutnya direduksi menjadi padatan mangan(IV) oksida yang berwarna coklat gelap (mangan oksida).
Reaksi yang terakhir ini juga merupakan reaksi yang akan terjadi apabila reaksi berlangsung pada kondisi netral. Hanya saja tidak ditemukan lagi adanya ion hidrogen atau ion hidroksida pada sebelah kiri persamaan reaksi.
Komplikasi-komplikasi
Produk yang terbentuk dari reaksi antara etena dengan Kalium Manganat(VII), yakni etana-1,2-diol, agak mudah dioksidasi oleh ion-ion manganat(VII), sehingga reaksi tidak akan terhenti setelah produk ini dihasilkan sebelum larutan kalium manganat(VII) sangat encer, sangat dingin, dan tidak pada kondisi asam.
Ini berarti bahwa reaksi ini tidak terlalu bermanfaat untuk digunakan dalam pembuatan etana-1,2-diol. Reaksi ini hanya bermanfaat dalam pengujian ikatan karbon-karbon rangkap – meski tidak begitu bagus!
Penggunaan reaksi etena dengan kalium manganat(VII) untuk menguji keberadaan ikatan C=C
Jika sebuah senyawa organik bereaksi dengan kalium manganat(VII) basa yang encer menghasilkan larutan hijau yang diikuti dengan endapan coklat gelap, maka senyawa organik tersebut kemungkinan mengandung sebuah ikatan rangkap C=C. Akan tetapi, senyawa organik tersebut bisa jadi salah satu dari banyak senyawa lain yang semua kandungannya bisa dioksidasi oleh ion-ion manganat(VII) dibawah kondisi basa.
Apabila larutan kalium manganat(VII) dalam kondisi asam maka situasinya lebih buruk lagi karena larutan ini memiliki kecenderungan untuk memutus ikatan karbon-karbon. Larutan ini bereaksi keras dengan berbagai senyawa organik dan jarang digunakan dalam kimia organik.
Anda dapat menggunakan larutan kalium manganat(VII) basa untuk menguji keberadaan ikatan C=C jika, misalnya, anda hanya ingin menentukan apakah sebuah hidrokarbon adalah alkana atau alkena – dengan kata lain, jika tidak ada lagi zat lain di dalamnya yang bisa dioksidasi.
Reaksi uji ini tidak begitu bermanfaat. Penggunaan air bromin jauh lebih jelas hasilnya.
2. Oksidasi dengan Ozonolisis
Untuk reaksi ozonolisis, pasti akan terjadi pemutusan rantai. Reaksi ini dibagi menjadi 2, yaitu ozonolisis reduktif dan oksidatif.
Contoh reaksi:
Dari gambar diatas, dapat kita simpulkan untuk reaksi ozonolisis reduktif (Zn, H2O) akan menghasilkan produk hingga tingkat karbonil saja (Aldehid dan Keton) sedangkan untuk reaksi ozonolisis oksidatif (H2O2) akan menghasilkan produk hingga tingkat asam karboksilat jika memungkinkan.
Sebagai tambahan, perlu anda ketahui bahwa ozon adalah zat reaktif yang bersifat karsogenik.
REAKSI ASAM BASA PADA SENYAWA AMINA
Amina
1. Pengertian
Amina adalah senyawa organic yang mengandung atom nitrogen trivalent yang mengandung atom nitrogen trivalen yang berkaitan dengan satu atau dua atau tiga atom karbon, dimana amina juga merupakan suatu senyawa yang mengandung gugusan amino (-NH2, - NHR, atau – NH2). Gugusan amino mengandung nitrogen terikat, kepada satu sampai tiga atom karbon (tetapi bukan gugusan karbonil). Apabila salah satu karbon yang terikat pada atom nitrogen adalah karbonil, senyawanya adalah amida, bukan amina.
Amina merupakan senyawa organik dan gugus fungsional yang isinya terdiri dari senyawa nitrogen atom dengan pasangan sendiri. Amino merupakan derivatif amoniak. Biasanya dipanggil amida dan memiliki berbagai kimia yang berbeda. Yang termasuk amina ialah asam amino, amino biogenik, trimetilamina, dan anilina.
Yang berbau dari amoniak, ialah ikan tua, air kencing, rotting daging, dan mani merupakan semua terdiri dari zat amino.
2. Ciri Khas
Di antara sejumlah golongan senyawa organic yang memiliki sifat basa, yang terpenting adalah amina. Di samping itu sejumlah amina memiliki keaktifan faali (fisiologis), misalnya efedrina berkhasiat sebagai peluruh dahak, meskalina yang dapat mengakibatkan seseorang berhalusinasi, dan amfetamina yang mempunyai efek stimulant. Kelompok senyawa alkaloid yang berasal dari tumbuhan secara kimia juga meripakan bagian dari golongan basa organic amina.
3. Runus Umum
Rumus umum untuk senyawa amina adalah :
¨ ¨
RNH2 R2NH R3N:
Dimana R dapat berupa alkil atau ari
B. Struktur
Amina merupakan senyawa organik yang terpenting dalam kehidupan sehari-hari dan memiliki urutan yang paling penting dalam senyawa organik, oleh karena itu amina tidak terlepas dari semua unsur organik yang lain. Oleh karena itu sifat-sifat yang di pelajari dalam senyawa amina akan sangat membantu dalam memahami aspek kimiawi kelompok alkoid yang mempunyai peran pentig dalam pembuatan obat-obat sinetik dewasa ini.
Senyawa Amina :
Amina Primer
Amina primer mengandung -NH2 terikat pada rantai atau cincin hidrokarbon. Anda dapat pikirkan amina sebagai turunan dari ammonia , NH3. Dalam amina primer, salah satu dari hidrogen diganti oleh hidrokarbon.
Contoh 1: Tuliskan struktur formula dari etilamin.
Dalam kasus ini, etil terikat pada -NH2 .
Nama ini (etilamin) tidak ada masalah selama tidak ada makna ambigu dari letak -NH2 . Namun seumpama anda mempunyai karbon rantai 3 -dalam kasus ini -NH2 bisa berada pada kedua ujung atau ditengah.
Contoh 2: Tuliskan struktur foemula untuk 2-aminopropan.
Nama menunjukkan rantai tiga karbon dengan amino terikat pada karbon ke dua. Amino menunjukkan -NH2 .
Etilamin (contoh1) bisa juga disebut sebagai aminoetan.
Amina Sekunder dan Tertier
Dalam amina sekunder dua dari hidrogen atom pada amonia digantikan dengan hidrokarbon. dan tiga hidrogen digantikan pada amina tertier.
Contoh 1: Tuliskan struktur formula untuk dimetilamine.
Dalam kasus ini dua atom hidrogen digantikan dengan metil.
Contoh 2: Tuliskan stuktur formula untuk trimetilamin.
Disini ada tiga hidrogen pada amonia yang digantikan dengan metil.
C. Tata Nama
Tata Nama IUPAC (Sistematik)
Nama sistematik untuk amina alifatik primer diberikan dengan cara seperti nama sistematik alkohol, monohidroksi akhiran –a dalam nama alkana induknya diganti oleh kata amina
Contoh :
CH3- CH-CH3 2-propanamina
│
NH2
CH3-CH2-CH-CH2-CH3 3-pentanamina
│
NH 3
Untuk amina sekunder dan tersier yang asimetrik (gugus yang terikat pada atom N tidak sama), lazimnya diberi nama dengan menganggapnya sebagai amina primer yang tersubtitusi pada atom N. Dalam hal ini berlaku ketentuan bahwa gugus sustituen yang lebih besar dianggap sebagai amina induk, sedangkan gugus subtituen yang lebih kecil lokasinya ditunjukkan dengan cara menggunakan awalan N (yang berarti terikat pada atom N)
Contoh :
CH3
N
CH3
N3N-dimetilsikopentamina
Tata Nama Trivial
Nama trivial untuk sebagian besar amina adalah dengan menyebutkan gugus-gugus alkil/aril yang terikat pada atom N dengan ketentuan bahwa urutan penulisannya harus memperhatikan urutan abjad huruf terdepan dalam nama gugus alkil/aril kemudian ditambahkan kata amina di belakang nama gugus-gugus tersebut
Contoh : CH3
│
CH3——NH2 CH — C — NH2
│
CH3
Metilamina tersier-butilamina
D. Klasifikasi
Amina digolongkan menjadi amina primer (RNH2), sekunder (R2NH), atau tersier (R3N), tergantung kepada jumlah atom karbon yang terikat pada atom nitrogen (bukan pada atom karbon, seperti pada alkohol)
Beberapa (10) Amin Primer (suatu karbon Terikat kepada N)
CH3
CH3NH2 CH3 C NH2 NH2
CH3
Beberapa (20) Amin sekunder (Dua Korbon terikat kepadaN)
CH3 — NH — CH3 NHCH3
N
H
Beberapa (30) Amin Tersier (Tiga karbon Terkait kepada N):
CH
CH3 — N — CH3 N
CH3 N
CH3
E. Sifat-Sifat Amina
1. Sifat Kimia
Kebasaan
Seperti halnya amonia, semua amina bersifat sebagai basa lemah dan larutan amina dalam air bersifat basis
Contoh : H
│
CH3—N: + H – O- H CH3- N- H + HO
│
H Metilamonium hidroksida
[CH3NH3][HO]
Kb = ———————— = 4,37 × 10-4
[CH3NH2]
Harga pKb untuk CH3NH2 = - log Kb = 3,36
Untuk menelaah kebasaan suatu amina, sering kali digunakan acuan tetapan ionisasi konjugatnya (Ka). Untuk asam konjugat dari CH3NH2 yaitu CH3NH3+ harga tetapan ionisasi asamnya adalah :
CH3NH3+ CH3NH2 + H+
[CH3NH2][H+]
Ka = = 4,37x10
[CH3NH3+]
Harga pKa untuk CH3NH3+ = -log Ka = 10,64
Harga pKa dan pKb untuk pasangan asam basa konjugat dinyatakan dengan persamaan: pKa + pKb =14
Reaksi Amina dngan Asam
Amina yang larut maupun yang tidak larut dalam air dapat bereaksi dengan asam dan menghasylkan garam yang larut dalam air.
Contoh :
(CH3CH2)2NH + HCl → (CH3CH2)2NH2+Cl-
dietilamonium klorida
2. Sifat Fisik
Contoh :
H H
│ │
ROH—:OR R2NH —:NR2
¨
5 kcal/mol 3kcal/mol
Titik didih dari amina yang mengandung suatu ikatan N—H adalah ditengah-tengah antara alkana (tidak ada ikatan hidrogen) dan alcohol (ikatan alcohol kuat)
CH3CH2CH3 CH3CH2NH2 CH3CH2OH
propana Etilamina Etanol
Berat rumus : 44 45 46
Titik didh (°C): -42 17 78,5
Titik didih dari amina yang tidak mengandung ikatan N—H, jadi tidak mempunyai ikatan hidrogen, lebih rendah dari amina yang mempunyai ikatan hidrogen.
F. Reaksi-Reaksi Amina
Reaksi Amina dengan Asam Nitrit
1. Amina alifatik primer dengan HNO2 menghasilkanalkohol disertai pembebasan gas N2 menurut persamaan reaksi di bawah ini :
CH3-CH-NH2 + HNO2→ CH3-CH-OH + N2 + H2O
│ │
CH3 CH3
Isopropilamina (amina 1°) isopropil alkohol (alkohol 2°)
2. Amina alifatik/aromatik sekunder dengan HNO2 menghasilkan senyawa N-nitrosoamina yang mengandung unsur N-N=O
Contoh :
H N=O
N + HNO2 → N + H2O
CH3 CH3
N-metilanilina N-metilnitrosoanilina
3. Amina alifatik/aromatik dengan HNO2 memberikan hasil reaksi yang ditentukkan oleh jenus amina tersier yang digunakan. Pada amina alifatik/aromatik tersier reaksinya dengan HNO2 mengakibatkan terjadinya sustitusi cincin aromatik oleh gugus –NO seperti contoh dibawah ini
CH3 CH2
N + HNO2 → N + H2O
CH3 CH3
N,N-dietilanilina p-nitroso –N,N- dimetilanilina
4. Amina aromatik primer jika direaksikan dengan HNO2 pada suhu 0°C menghasilkan garam diazonium
Contoh :
+
NH2 + HNO2 + HCl N= : Cl + 2H2O
Anilina benzenadiaazonium klorida
Reaksi Amina dengan Asam
Contoh :
(CH3CH2)2NH + HCl (CH3CH2)2NH+Cl-
Dietilamonium klorida
G. Pembuatan Amina
Ada dua jalan umumuntuk pembentukan amina yaitu subtitusi dan reduksi.
Reaksi Subtitusi dari Alkil Halida
Ammonia dan mengandung pasangan elektron sunyi pada atom nitrogen, oleh sebab itu, senyawa itu dapatbertindak sebagai nukleofil dalm reaksi subtitusi nukleofilik dari alkil halida. Reaksi dengan amonia menghasilkan garam dari amin primer. Bila garam amina ini direaksikan dengan basa akan dibebaskan amina bebas.
Reaksi alkil halida dengan amina dan bukan amonia akan menghasilkan amin sekunder, tersier, atau garam amonium kuarterner, tergantung pada amina yang digunakan. +
CH3CH2Br + CH3CH2 CH3CH2NH2CH3 Br - - OH CH3CH2NH2CH3
10 amina 20 amina
+
CH3CH2Br + (CH3)2 NH CH3CH2NH2 (CH3)2 Br - - OH
20 amina
CH3CH2N(CH3)2
30 amina
CH3CH2Br + (CH3)3 N CH3CH2N(CH3)2
Reaksi Reduksi dari Senyawa Nitrogen lain
Reduksi dari amida atau nitril dengan litium aluminium hidrida atau dengan gas hidrogen (hidrogenasi katalitik) menghasilkan amina. Dengan amida, amin primer, sekunder, atau tersier bisa didapat, tergantung kepada jumlah substitusi pada amida nitrogen.
Amida yang disubtitusi
CH3CH2CH2 —C N CH3CH2CH2- CH2NH2
pertanyaan :
1. apabila alkena dioksidasi dengan kalium permangat pada suhu dingin maka yang dihasilkan adalah senyawa keton , asam karboksilat ,aldehid dan alkohol . Lalu bagaiman jika alkena dioksidasi dalam suasana panas , apakah keempat senyawa tersebut masih dihasilkan atau adakah senyawa yg dihasilkan selain dari yang ke empat senywa tersebut ???
2. alkaloid adalah senyawa yang mengandung nitrogen yang bersifat basa dari tumbuhan atau hewan , salah satu penghasil alkaloid yang berarti adalah katak beracun .Katak ini mensekresikan alkaloid beracun dari permukaan kulitnya . yang paling beracun dari sekresi ini adalah batrakotoksin , bagaimana proses terjadinya batrakotoksin dalam sekresi permukaan kulit katak sehingga bisa menghasilkan senyawa yang alkaloid yang sangat beracun sementarabiasanya alkaloid digunakan untuk bahan obat- obatan . bagaimana struktur amina dalam btrakotoksin tersebut ???