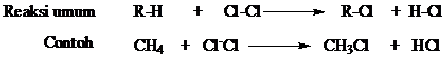Halogenasi Alkana dan Sikloalkana
Alkana
Reaksi dari alkana dengan unsur-unsur halogen disebut reaksi halogenasi.
Reaksi ini akan menghasilkan senyawa alkil halida, dimana atom hidrogen
dari alkana akan disubstitusi oleh halogen sehingga reaksi ini bisa
disebut reaksi substitusi.
Halogenasi biasanya menggunakan klor dan brom sehingga disebut juga klorinasi dan brominasi.
Halongen lain, fluor bereaksi secara eksplosif dengan senyawa organik
sedangkan iodium tak cukup reaktif untuk dapat bereaksi dengan alkana.
Laju pergantian atom H sebagai berikut H3 > H2 > H1. Kereaktifan halogen dalam mensubtitusi H yakni fluorin > klorin > brom > iodin.
Reaksi antara alkana dengan fluorin menimbulkan ledakan (eksplosif) bahkan pada suhu dingin dan ruang gelap.
Jika campuran
alkana dan gas klor disimpan pada suhu rendah dalam keadaan gelap,
reaksi tidak berlangsung. Jika campuran tersebut dalam kondisi suhu
tinggi atau di bawah sinar UV, maka akan terjadi reaksi yang eksoterm.
Reaksi kimia dengan bantuan cahaya disebut reaksi fitokimia.
Dalam reaksi
klorinasi, satu atau lebih bahkan semua atom hidrogen diganti oleh atom
halogen. Contoh reaksi halogen dan klorinasi secara umum digambarkan
sebagai berikut:
Reaksi antara alkana dengan fluorin
Reaksi ini menimbulkan ledakan (eksplosif) bahkan pada suhu dingin dan ruang gelap, dan cenderung dihasilkan karbon dan hidrogen fluoride. Tidak ada yang istimewa pada reaksi ini. Sebagai contoh:
Reaksi antara alkana dengan iodin
Iodin tidak bereaksi dengan alkana – sekurang-kurangnya pada kondisi laboratorium yang normal.
Reaksi antara alkana dengan klorin atau bromin
Tidak ada reaksi yang terjadi dalam kondisi gelap (tanpa cahaya).
Jika terdapat cahaya, reaksi yang terjadi sedikit mirip dengan fluorin, yakni menghasilkan sebuah campuran karbon dan hidrogen halida. Keagresifan reaksi berkurang tajam semakin ke bawah golongan mulai dari fluorin sampai klorin sampai bromin.
Reaksi-reaksi yang menarik terjadi dengan adanya sinar ultraviolet (begitu juga sinar matahari). Reaksi-reaksi ini disebut reaksi fitokimia, dan terjadi pada suhu kamar.
Berikut kita akan melihat reaksi dengan klorin. Reaksi dengan bromin cukup mirip, hanya saja sedikit lebih lambat.
Metana dan klorin
Reaksi substitusi terjadi dengan mekanisme dimana atom-atom hidrogen dalam metana digantikan oleh atom-atom klorin. Hasil reaksi adalah campuran klorometana, diklorometana, triklorometana dan tetraklorometana.

Campuran antara gas tidak berwarna dengan sebuah gas berwarna hijau ini akan menghasilkan hidrogen klorida dalam bentuk uap asap dan kabut cairan-cairan organik. Semua produk organik berbentuk cair dalam suhu kamar terkecuali klorometana yang merupakan sebuah gas.
Jika klorin diganti dengan bromin, anda bisa mencampur metana dengan uap bromin, atau menggelembungkan metana melalui cairan bromin – paparkan kedua prosedur ini terhadap sinar UV. Campuran gas yang terbentuk akan berwarna merah-coklat dan bukan hijau.
Reaksi-reaksi ini tidak bisa digunakan untuk membuat senyawa-senyawa organik yang dihasilkan dalam laboratorium karena campuran hasil reaksinya sangat sulit dipisahkan.
Mekanisme dari reaksi-reaksi ini akan dijelaskan pada halaman yang lain.
Reaksi alkana-alkana yang lebih besar dengan klorin
Reaksi ini lagi-lagi akan menghasilkan campuran produk-produk substitusi, tapi kita hanya akan melihat secara ringkas apa yang terjadi jika hanya satu atom hidrogen yang tersubstitusi (monosubstitusi) – sekedar untuk menunjukkan bahwa mekanisme yang terjadi tidak selamanya sederhana sebagaimana yang dipahami.
Sebagai contoh, dengan propana, akan diperoleh salah satu dari dua isomer berikut:

Sebenarnya, jumlah setiap dari dua isomer ini yang diperoleh hampir sama.
Jika digunakan bromin, kebanyakan hasil reaksi adalah isomer dimana bromin terikat pada atom karbon tengah, bukan pada atom karbon ujung.
Penyebab terjadinya mekanisme ini akan dibahas pada pembahasan yang lain.
Sikloalkana
Reaksi sikloalkana pada umumnya hampir sama dengan alkana, kecuali untuk sikloalkana yang sangat kecil – khususnya siklopropana.
Kereaktifan tambahan siklopropana
Dibawah sinar UV, siklopropana akan mengalami reaksi substitusi dengan klorin atau bromin tepat seperti yang dialami alkana non-siklik. Akan tetapi, sikloalkana juga memiliki kemampuan untuk bereaksi dalam kondisi tanpa cahaya.
Dengan adanya sinar UV, siklopropana bisa mengalami reaksi adisi dimana cincinnya terputus. Sebagai contoh, dengan bromin, siklopropana menghasilkan 1,3-dibromopropana.

Reaksi ini masih bisa terjadi dengan adanya sinar biasa – tetapi reaksi substitusi juga terjadi pada kondisi ini.
Struktur cincin terputus karena siklopropana mengalami regangan cincin. Sudut-sudut ikatan dalam cincin menjadi 60° dan tidak normal lagi yaitu sekitar 109.5° ketika karbon membentuk empat ikatan tunggal.
Timpang tindih antara orbital-orbial atom dalam pembetukan ikatan C-C tidak lagi seperti pada keadaan normal, dan terjadi tolak-menolak yang cukup besar antara pasangan-pasangan elektron ikatan. Sistem akan menjadi lebih stabil jika cincin terputus.
Reaksi antara alkana dengan halogen disebut dengan reaksi "halogenasi radikal bebas". Atom hidrogen pada alkana akan secara bertahap digantikan oleh atom-atom halogen. Radikal bebas adalah senyawa yang ikut berpartisipasi dalam reaksi, biasanya menjadi campuran pada produk. Reaksi halogenasi merupakan reaksi eksotermik dan dapat menimbulkan ledakan.
Reaksi ini sangat penting pada industri untuk menghalogenasi hidrokarbon. Ada 3 tahap:
- Inisiasi: radikal halogen terbentuk melalui homolisis. Biasanya, diperlukan energi dalam bentuk panas atau cahaya.
- Reaksi rantai atau Propagasi: radikal halogen akan mengabstrak hidrogen dari alkana untuk membentuk radikal alkil.
- Terminasi rantai: tahap dimana radikal-radikal bergabung.

§Alkanadapatbereaksidenganhalogen
(F2, Cl2, Br2, I2) menghasilkanalkilhalida.
§Urutanreaktifitas:
F2> Cl2> Br2> I2
§ReaksidenganI2
berlangsungsangatlambat.
§ReaksialkanadenganCl2danBr2berlangsungtidakseberapacepatsehinggamudahdikendalikan.
§ReaksialkanadenganF2berlangsungsangatcepatsehinggasulitdikendalikan.
REAKSI PADA HALOGENASI
1.InisiasiAtom klorinmemilikisatuelektronyang tidakberpasangan,
danberlakusebagaisuaturadikalbebas.Pemecahanhomolisisterhadapmolekulklorinmenjadi2
atom klorin, yang disebabkanolehradiasibiru(diberisimbolhn)
•Energidarisatuphoton sinardapatdihitungdenganmenggunakanpersamaan:E= hv= 250 kJ per mol photondenganh = konstantaPlanckv = frekuensi
2.Propagasiberantai(2 tahap)
3.Terminasi
Rekombinasi radikal bebas
Rekombinasi2 radikalbebas:
Reaksi antara alkana dengan fluorin
Reaksi ini menimbulkan ledakan (eksplosif) bahkan pada suhu dingin dan ruang gelap, dan cenderung dihasilkan karbon dan hidrogen fluoride. Tidak ada yang istimewa pada reaksi ini. Sebagai contoh:


Reaksi antara alkana dengan iodin
Iodin tidak bereaksi dengan alkana – sekurang-kurangnya pada kondisi laboratorium yang normal.
Reaksi antara alkana dengan klorin atau bromin
Tidak ada reaksi yang terjadi dalam kondisi gelap (tanpa cahaya).
Jika terdapat cahaya, reaksi yang terjadi sedikit mirip dengan fluorin, yakni menghasilkan sebuah campuran karbon dan hidrogen halida. Keagresifan reaksi berkurang tajam semakin ke bawah golongan mulai dari fluorin sampai klorin sampai bromin.
Reaksi-reaksi yang menarik terjadi dengan adanya sinar ultraviolet (begitu juga sinar matahari). Reaksi-reaksi ini disebut reaksi fitokimia, dan terjadi pada suhu kamar.
Berikut kita akan melihat reaksi dengan klorin. Reaksi dengan bromin cukup mirip, hanya saja sedikit lebih lambat.
Rekombinasi2 radikalbebas:
Reaksi antara alkana dengan fluorin
Reaksi ini menimbulkan ledakan (eksplosif) bahkan pada suhu dingin dan ruang gelap, dan cenderung dihasilkan karbon dan hidrogen fluoride. Tidak ada yang istimewa pada reaksi ini. Sebagai contoh:
Reaksi antara alkana dengan iodin
Iodin tidak bereaksi dengan alkana – sekurang-kurangnya pada kondisi laboratorium yang normal.
Reaksi antara alkana dengan klorin atau bromin
Tidak ada reaksi yang terjadi dalam kondisi gelap (tanpa cahaya).
Jika terdapat cahaya, reaksi yang terjadi sedikit mirip dengan fluorin, yakni menghasilkan sebuah campuran karbon dan hidrogen halida. Keagresifan reaksi berkurang tajam semakin ke bawah golongan mulai dari fluorin sampai klorin sampai bromin.
Reaksi-reaksi yang menarik terjadi dengan adanya sinar ultraviolet (begitu juga sinar matahari). Reaksi-reaksi ini disebut reaksi fitokimia, dan terjadi pada suhu kamar.
Berikut kita akan melihat reaksi dengan klorin. Reaksi dengan bromin cukup mirip, hanya saja sedikit lebih lambat.
permasalahan : mengapa campuran alkana dan gas klor dan brom tidak bereaksi pada suhu rendah dan keadaan yang gelap dan hanya bereaksi pada suhu tinggi dan keaadan terang ??? sedangkan fluorin dapat bereaksi dengan alkana walaupun pada suhu rendah dan keadaan gelap sehingga dapat menimbulkan ledakan . Apa yang menyebabkan perbedaan tersebut ?